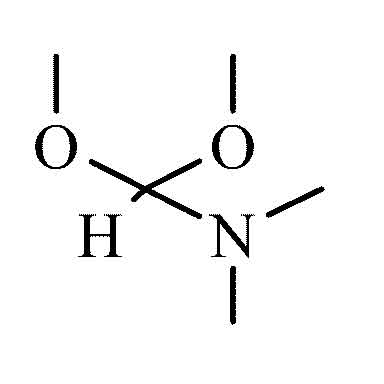
Dimethylformamiddimethylacetal ist das durch Acetalisierung von Dimethylformamid mit Methanol gebildete und zwei Alkoxygruppen an der Carbonylgruppe tragende Amid-Acetal. Die Verbindung hat als Formylierungsreagenz und Methylierungsmittel für Carbonsäuren, Phenole, Amine, Thiole und Aminosäuren sowie als Molekülbaustein (building block), insbesondere für Heterocyclen, größere Verbreitung gefunden.
Vorkommen und Darstellung
Analog der ersten Veröffentlichung über Dimethylformamid-diethylacetal aus dem Arbeitskreis von Hellmut Bredereck wird das Dimethylformamiddimethylacetal des durch Umsetzung (O-Methylierung) von Dimethylformamid mit Dimethylsulfat erhaltenen Addukts mit Natriummethanolat in Methanol bei 0 °C in Ausbeuten von 72 bis 87 % erhalten.
Wegen der Zersetzung des DMF-DMA bei der Destillation unter Normaldruck wird die schnelle Destillation des Reaktionsgemischs unter Zugabe von Methanol als Schleppmittel und anschließende fraktionierte Destillation des erhaltenen Methanol/DMF-DMA-Gemischs empfohlen. Dadurch werden Reinausbeuten von Dimethylformamiddimethylacetal von 85 bis 90 % erreicht.
Die Reaktion des Vilsmeier-Reagenz' N,N-Dimethyl(chlormethylen)iminiumchlorid in Chloroform mit Natriummethanolat in Methanol liefert DMF-DMA in 55%iger Ausbeute.
Dimethylformamiddimethylacetal entsteht auch bei Umsetzung der Reaktanden Methanolat, DMF und CHCl3. Dabei reagiert Chloroform mit festem Natriummethanolat oder Natriummethanolat in Methanol vermutlich über das intermediär gebildete Dichlorcarben :CCl2, das Dimethylformamid unter CO-Abspaltung zu DMF-DMA umsetzt.
In millimolaren Ansätzen werden Rohausbeuten bis 91 % erzielt.
Eigenschaften
Dimethylformamiddimethylacetal ist eine klare, farblose, aminartig riechende Flüssigkeit, die sich mit Wasser und vielen organischen Lösungsmitteln mischt. In Wasser zersetzt sich das Acetal allmählich.
Anwendungen
DMF-DMA als Methylierungsmittel
Acide Verbindungen, wie z. B. Carbonsäuren, Phenole, Thiole werden von Dimethylformamiddimethylacetal in glatter Reaktion methyliert,
ebenso wie NH-Heterocyclen, wie z. B. Triazole.
DMF-DMA als Formylierungsmittel
Dimethylformamiddimethylacetal reagiert mit primären Aminen zu N,N-Dimethylformamidinen und mit α-Aminosäuren zu den entsprechenden relativ stabilen α-Formamidinomethylestern.
Die α-Formamidinomethylester können mit guten Ausbeuten nach Deprotonierung mit starken Basen, wie z. B. Lithiumdiisopropylamid LDA oder Kalium-tert-butanolat KOtBu mit Alkylhalogeniden, wie z. B. Iodmethan alkyliert oder in einer Michael-Addition mit z. B. Acrylsäuremethylester umgesetzt werden.
Als Alternative zur eher als Laborverfahren geeigneten Synthese des cyclischen Polyamins Cyclen nach Reed und Weisman eignet sich die Umsetzung von Triethylentetramin TETA mit DMF-DMA unter Bildung des Bis-Amidins 1,1'-Ethylendi-2-imidazolin in 85%iger Ausbeute (1. Stufe). Dessen Makrocyclisierung unter Verdünnungsbedingungen mit 1,2-Dibromethan liefert eine Monoimidazolium-Verbindung mit 70%iger Ausbeute, die anschließend mit kochender Kalilauge in einer Ausbeute von 88 % zum Cyclen gespalten wird.
Durch Reaktion von Dimethylformamiddimethylacetal mit sekundären Aminen werden die entsprechenden N-Formyl-N,N-dialkylamine gebildet.
Mit CH-aciden Verbindungen mit aktivierten Methylengruppen, wie z. B. Ketonen, reagiert DMF-DMA glatt zu vinylogen Amiden, den so genannten Enaminonen.
So bildet Cyclopentanon mit DMF-DMA in 86%iger Ausbeute das entsprechende Enaminon, das mit Lithiumaluminiumhydrid LiAlH4 in 88%iger Ausbeute die entsprechende Mannich-Base ergibt.
Mit Diketonen werden analog Bis-Enaminone gebildet, aus denen eine Vielzahl von Heterocyclen zugänglich sind.
Das bei der Reaktion von 2,6-Diacetylpyridin mit DMF-DMA praktisch quantitativ entstehende Bis-Enaminon reagiert mit Hydrazin zum 3-Arylpyrazol.
Eine effektive Methode zur Herstellung substituierter Indole ist die in der englischen Literatur so genannte „Leimgruber-Batcho indole synthesis“ aus 2-Nitrotoluolen und Dimethylformamiddimethylacetal, wobei zur Reaktionsbeschleunigung Pyrrolidin zugesetzt wird.
In Gegenwart von Natriummethanolat-Spuren bildet sich aus β-Nitrostyrolen und zwei Äquivalenten DMF-DMA in DMF in mäßigen Ausbeuten (bis 40 %) 1,3,5-Triphenylbenzole.
Andere Reaktionen mit DMF-DMA
Wie das homologe Dimethylformamid-diethylacetal kann DMF-DMA mit überschüssigen höheren Alkoholen zu den entsprechenden Dimethylformamid-dialkylacetalen umacetalisiert werden (Umacetalisierung).
Die Umamidierung von DMF-DMA mit Dibenzylamin liefert N,N-Dibenzylformamiddimethylacetal, das sich als Schutzgruppe für primären Amine eignet, mit denen es glatt zu Amidinen reagiert. Diese Schutzgruppe ist gegenüber Säuren, Basen und Nukleophilen stabil und kann durch katalytische Hydrierung mit Palladium(II)-oxid auf Aktivkohle wieder abgespalten werden.
Dimethylformamiddimethylacetal kann als Scavenger für Schwefelwasserstoff H2S und Mercaptane in Erdgas und kohlenwasserstoffbasierten Treibstoffen, wie z. B. Benzin, Diesel oder Kerosin eingesetzt werden.
Mit 1,2-Diolen, wie z. B. trans-Cyclohexan-1,2-diol, reagiert DMF-DMA in hoher Ausbeute (88 %) unter Konfigurationsumkehr zum Epoxid Cyclohexenoxid.
Einzelnachweise